
- DAZ.online
- News
- Politik
- Nächster Schritt beim ...
Referentenentwurf
Nächster Schritt beim OTC-Switch von Azelastin/Fluticason-Nasenspray
Berlin - 19.11.2024, 13:45 Uhr

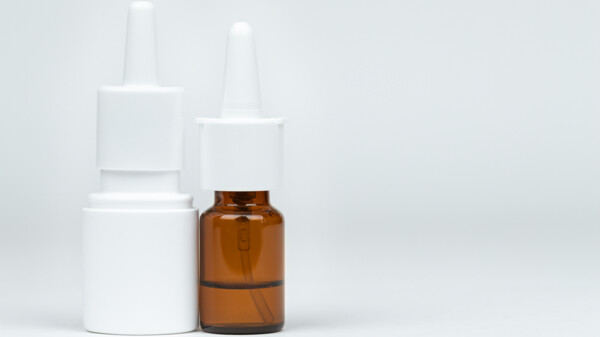
Erwachsene mit allergischer Rhinitis sollen künftig auch Fluticason/Azelastin rezeptfrei in Apotheken erhalten. (Foto: New Africa/AdobeStock)
Im Juli hat der Sachverständigen-Ausschuss für Verschreibungspflicht entschieden, dass kombinierte Allergie-Nasensprays aus Fluticason/Azelastin künftig ohne Rezept zu haben sein sollen. Nun liegt der Referentenentwurf für die notwendige Änderung der Arzneimittelverschreibungsverordnung vor.
Hat der Sachverständigen-Ausschuss für Verschreibungspflicht sich dafür ausgesprochen, ein Arzneimittel aus der Verschreibungspflicht zu entlassen, dauert es immer noch geraume Zeit, bis der Switch dann wirklich vollzogen wird, sprich die jeweiligen Arzneimittel dann in der Sichtwahl stehen. Schließlich muss dazu die Arzneimittelverschreibungsverordnung (AMVV) geändert werden. So auch bei der Kombination von Fluticason und Azelastin als Nasenspray. Nachdem der Switch 2023 bereits zum zweiten Mal abgelehnt wurde, berieten die Sachverständigen im Juli 2024 erneut und entschieden, dass entsprechende Präparate künftig ohne ärztliche Verschreibung zu haben sein sollen.
Mehr zum Thema

Nach ärztlicher Erstdiagnose
Azelastin/Fluticason-Nasensprays künftig ohne Rezept

Sachverständigen-Ausschuss für Verschreibungspflicht
Warum Azelastin/Fluticason-Nasenspray vorerst verschreibungspflichtig bleibt
Der Referentenentwurf des Bundesgesundheitsministeriums (BMG), der die entsprechende Änderung der AMVV vorsieht, liegt nun vor. Er ist auf den 4. November 2024 datiert. Demnach soll in der Anlage 1 der AMVV, in der verschreibungspflichtige Wirkstoffe gelistet sind, bei der Position „Zubereitung aus Azelastin und Fluticasonpropionat“ Folgendes eingefügt werden:
„ausgenommen Zubereitungen aus Azelastin und Fluticasonpropionat zur intranasalen Anwendung bei Erwachsenen zur symptomatischen Behandlung der mittelschweren bis schweren saisonalen allergischen Rhinitis, nach deren Erstdiagnose durch einen Arzt und wenn eine Monotherapie entweder mit einem intranasalen Antihistaminikum oder einem Glukokortikoid nicht als ausreichend erachtet wird, in einer Tagesdosis bis zu 200 Mikrogramm Fluticasonpropionat, sofern auf Behältnissen und äußerer Umhüllung angegeben ist, dass die Anwendung auf Erwachsene beschränkt ist “
Referentenentwurf der 22. Verordnung zur Änderung der Arzneimittelverschreibungsverordnung
Bundesrat muss zustimmen
Damit die Änderung in Kraft tritt, muss noch der Bundesrat seinen Segen geben und sie muss im Bundesanzeiger veröffentlicht werden. Üblicherweise tritt sie am Tag nach der Veröffentlichung in Kraft. Zunächst einmal findet aber noch ein Stellungnahmeverfahren statt.
Und dann müssen natürlich auch noch entsprechende Präparate zur Verfügung stehen. Laut BMG erfüllt keines der derzeit 22 verkehrsfähigen, verschreibungspflichtigen und national zugelassenen Kombinationsarzneimittel die Ausnahmeregelungen, das heißt: Sie bleiben verschreibungspflichtig und können nicht einfach nur umgepackt werden.

























0 Kommentare
Kommentar abgeben