
- DAZ.online
- News
- Pharmazie
- Welche Arzneimittel 2018 ...
Biosimilars & Generika
Welche Arzneimittel 2018 aus dem Patent laufen
Berlin - 19.01.2018, 16:30 Uhr

Hinter den kommenden Patentabläufen steckt ein Umsatzpotenzial von 1324 Millionen Euro. (Bild: weyo / stock.adobe.com)
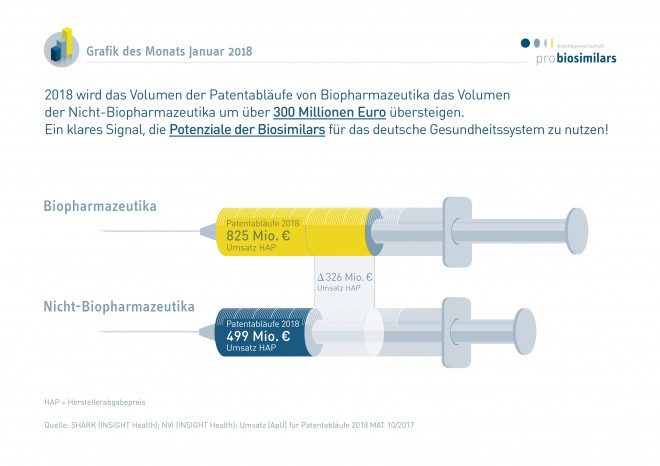
In diesem Jahr laufen nach Information der Arbeitsgemeinschaft Pro Biosimilars mehrere Arzneimittel-Patente aus, hinter denen in Deutschland ein Umsatzpotenzial von insgesamt 1.324 Millionen Euro steckt. Davon entfällt der Hauptanteil von 825 Millionen Euro auf das Antikörper-Präparat Humira® – das Wettrennen der Biosimilars ist bereits in vollem Gange. Bei den Nicht-Biopharmazeutika stehen für die Generika-Unternehmen unter anderem Atripla®, Targin® und Ezetrol® zur Disposition.
Der monoklonale Antikörper Adalimumab (Humira®) verliert diesen Herbst seinen Patentschutz. Das Antirheumatikum war nach Daten des GKV-Arzneimittelindex 2016 das umsatzstärkste Präparat. Hersteller Abbvie erwirtschaftete nach Informationen von Insight Health mit Humira® allein in Deutschland 825 Millionen Euro. „Es ist eine einmalige Situation, dass mit dem Patentablauf eines einzigen Moleküls so viel Umsatz frei wird“, kommentiert Pro-Generika-Geschäftsführer Bork Bretthauer gegenüber dem Handelsblatt.
Wettrennen der Adalimumab-Biosimilars
Der monoklonale Antikörper gegen den Tumor-Nekrose-Faktor alpha (TNF-α) verfügt über ein großes Indikationsspektrum und wird unter anderem bei Rheumatoider Arthritis, Plaque-Psoriasis und chronisch-entzündlichen Darmerkrankungen eingesetzt. Das ist ein attraktives Therapiefeld, weshalb bereits mehrere Unternehmen in den Startlöchern stehen, den Blockbuster nachzubilden.
Als Reaktion auf den nahenden Wettbewerb hat Originator Abbvie in den letzten Monaten mehrere Rabattverträge abgeschlossen, um mit seinem bislang nahezu konkurrenzlosen Humira® weiter im Geschäft zu bleiben. „Nur die Verfügbarkeit von Biosimilars löst im Biologikamarkt Wettbewerb aus. Originalhersteller versuchen sich daher oft, durch das flächendeckende Schließen von Rabattverträgen vor diesem Wettbewerb zu schützen“, erläutert Pro Generika-Geschäftsführer Bork Bretthauer gegenüber DAZ.online.
Nach dem Bericht der Europäischen Arzneimittelagentur EMA vom 8. Januar liegen derzeit fünf Zulassungsanträge für Adalimumab-Biosimilars zum Review vor, darunter von Sandoz und Fresenius. Im vergangenen Jahr erteilte die EMA den Unternehmen Amgen, Samsung (Imraldi®) und Boehringer (Cytelzo®) Zulassungen für ihre Biosimilars. Dabei bekam Amgen sogar grünes Licht für zwei Produkte (Solymbic®) und (Amgevita®), die sich in ihren Anwendungsgebieten unterscheiden.





















0 Kommentare
Das Kommentieren ist aktuell nicht möglich.