
- DAZ.online
- News
- Pharmazie
- Checkpoint-Inhibitoren: ...
Immunonkologische Therapien
Checkpoint-Inhibitoren: Dafür gab es den Medizin-Nobelpreis
Stuttgart - 01.10.2018, 17:55 Uhr

Die Arbeiten der diesjährigen Medizin-Nobelpreisträger James Allison und Tasuku Honjo sind Grundlage der Wirkstoffklasse der Checkpoint-Inhibitoren. ( r / Foto: imago)
Die Arbeiten der Medizin-Nobelpreisträger 2018, James Allison und Tasuku Honjo, sind die Grundlage der Wirkstoffklasse der Checkpoint-Inhibitoren. Die Wirkung der innovativen Krebsarzneimittel basiert darauf, das eigene Immunsystem gegen den Tumor zu aktivieren. Eine ganze Reihe von Wirkstoffen hat bereits die Marktreife erlangt.
Der Nobelpreis für Medizin geht in diesem Jahr an James Allison und Tasuku Honjo. Auf Basis ihrer Arbeiten ist eine neue Wirkstoffklasse entstanden: Die sogenannten Checkpoint-Inhibitoren, die bereits seit einigen Jahren Eingang in die Krebstherapie gefunden haben. Zunächst beim metastasierten Melanom, dessen Prognose sie drastisch verbessert haben, später auch bei anderen Krebserkrankungen. Die Idee dahinter ist folgende: Die Bremse, die bei vielen Krebserkrankungen verhindert, dass der Tumor vom eigenen Immunsystem bekämpft wird, soll aufgehoben werden. So soll die Abwehr gegen die Krebszellen aktiviert werden. Und eben diese „Bremsen“ haben die aktuellen Nobelpreisträger entdeckt, beziehungsweise erforscht.
Mehr zum Thema

Von der unspezifischen Aktivierung zu passgenauen Checkpoint-Inhibitoren
Antikörper-Offensive gegen Krebs
Seit 2011 wurde bereits eine ganze Reihe von Immuntherapeutika auf Basis der Erkenntnis der Nobelpreisträger von der FDA (US Food and Drug Administration) und der EMA (European Medicines Agency) zugelassen.
Die Bremse lösen
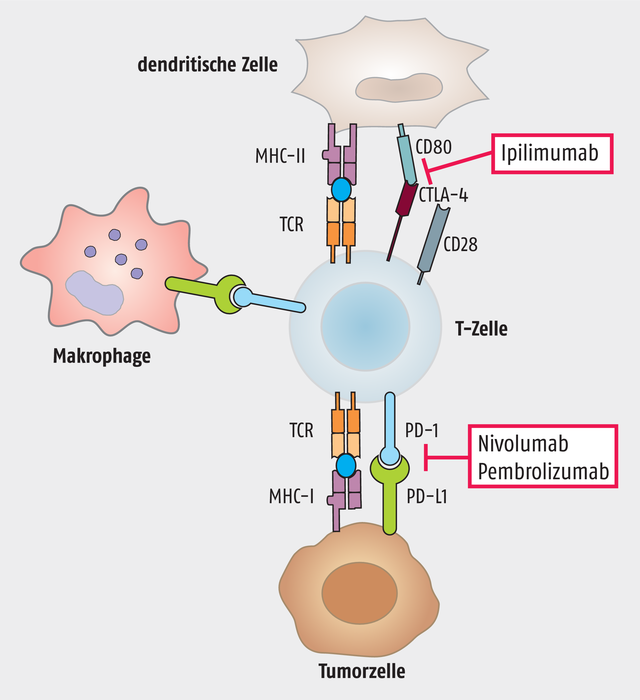
Eine der oben erwähnten „Bremsen“ ist das Protein CTLA-4, als dessen Entdecker der US-Amerikaner und frisch gebackene Nobelpreisträger Allison gilt. CTLA-4 (Synonym CD152) steht für Cytotoxic T-Lymphocyte Antigen-4. Es handelt sich dabei um ein Protein, das speziell an der Zelloberfläche von T-Zellen exprimiert wird. Die Aufgabe von CTLA-4 besteht darin, überschießende Immunreaktionen zu verhindern. Das funktioniert folgendermaßen:
Eine „normale“ Immunantwort geht immer mit positiven und inhibitorischen kostimulatorischen Signalen einher, die eine T-Zelle während einer antigenspezifischen Stimulation durch eine antigenpräsentierende Zelle erhält. CTLA-4 und CD28 sind zwei wichtige kostimulatorische Rezeptoren.
Während über CD28 die T-Zelle aktiviert wird – es kommt zur Proliferation und Expression von IL-2 –, blockiert CTLA-4 die Signaltransduktion der T-Zelle. Zudem führt die Aktivierung von CTLA-4 zur Expression von TGF-β, einem Zytokin, das immunsuppressiv wirkt.
Da CTLA-4 und CD28 um dieselben Liganden (CD80 und CD86) konkurrieren, treten immer hemmende und aktivierende Effekte gemeinsam auf. Die Bindung an CD28 für die T-Zell-Aktivierung stellt ein kostimulatorisches Signal dar, die Bindung von CTLA-4 hingegen kann über zahlreiche Signalwege T-Zellen inaktivieren. Manche Tumore exprimieren vermehrt CTLA-4. Die Blockade von CTLA-4 führt sozusagen zu einer Reaktivierung der T-Zellfunktion, die sich dann gegen den Tumor richten kann.
Diese Präparate gibt es bereits auf dem Markt
Diesen Wirkansatz verfolgt der Antikörper Ipilimumab (Yervoy®), der sich gegen CTLA-4 richtet und somit dessen inhibitorische Wirkung aufhebt. Das Arzneimittel wird als Monotherapie bei fortgeschrittenen (nicht resezierbaren oder metastasierten) Melanomen bei Erwachsenen und Jugendlichen ab einem Alter von zwölf Jahren eingesetzt; außerdem in Kombination mit Nivolumab, zur Behandlung von fortgeschrittenen (nicht resezierbaren oder metastasierten) Melanomen bei Erwachsenen.
Der PD-L1-Weg
Ein weiteres Protein, das Immunreaktionen herunter regeln kann, ist PD-L1, der „Programmed cell death 1 ligand 1“. PD-L1 ist Gegenstand der Arbeiten des zweiten Nobelpreisträgers, des Japaners Tasuku Honjo. Bindet PD-L1 an seinen Rezeptor PD-1, wird die Immunantwort gehemmt. In manchen Tumoren wird PD-L1 überexprimiert. Blockiert man diesen Signalweg, wird die Immunantwort wieder aktiviert.
Das wird derzeit in der Therapie auf zwei verschiedene Arten verwirklicht: Zum einen über die Blockade des Rezeptors, zugelassene Wirkstoffe sind hier Nivolumab (Opdivo®) und Pembrolizumab (Keytruda®). Zum anderen über die Blockade des Liganden. Auf diesem Prinzip basieren Atezolizumab (Tecentriq®), Avelumab (Bavencio®) und Durvalumab (Imfinzi®). Letzterer erhielt erst vergangene Woche die EU-Zulassung beim fortgeschrittenen, inoperablen nicht-kleinzelligen Lungenkrebs (NSCLC) bei Erwachsenen.
Neuer Wirkansatz, neue Nebenwirkungen
Diese völlig neuen Wirkansätze bringen allerdings auch völlig neue Nebenwirkungen mit sich. So kann sich unter einer Immuntherapie das Immunsystem nicht nur gegen den Tumor, sondern mitunter auch gegen gesunde Strukturen richten. Zu den häufigsten Nebenwirkungen zählten Fieber, Hautausschläge, Juckreiz, Entzündungen der Verdauungsorgane sowie des endokrinen Systems. Die unerwünschten Wirkungen können von subklinisch bis fatal schwanken und rasch oder erst nach Wochen und Monaten auftreten. Im schlimmsten Fall kommt es zu einem Zytokin-Sturm, der bis zu einem völligen Organversagen führen kann.
Mehr zum Thema

Verdachtsfälle
Bisher unbekannte Nebenwirkungen bei Checkpoint-Inhibitoren
PD-l1-Antikörper
Freud und Leid bei den Checkpoint-Inhibitoren
Im vergangenen Jahr forderte das Paul-Ehrlich-Institut im Bulletin zur Arzneimittelsicherheit noch einmal explizit dazu auf, Verdachtsfälle von unerwünschten Wirkungen, die im Zusammenhang mit der Therapie mit einem der Checkpoint-Inhibitoren stehen, zu melden, damit Erkenntnisse zum Nebenwirkungsprofil gewonnen werden.




















1 Kommentar
Autorenlob
von Dr Schweikert-Wehner am 02.10.2018 um 10:11 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.