
- DAZ.online
- DAZ / AZ
- DAZ 27/2020
- Hoffen auf Hintergrund...
Pandemie Spezial
Hoffen auf Hintergrundimmunität
Reaktive T-Zellen dank zirkulierender Coronaviren eröffnen neue Perspektiven
So lieferten Berliner Wissenschaftler und Forscher des La Jolla Institute for Immunology in San Diego, USA, in zwei unabhängigen Studien entscheidende Hinweise zum besseren Verständnis der immunologischen Reaktionen unseres Körpers auf die neuartige Viruserkrankung, insbesondere dazu, welche viralen Strukturen von T-Zellen erkannt werden und wie sich eine frühere Exposition mit Erkältungs-Coronaviren auswirken kann.
Grundlegende Fragen
Wie reagiert unser Immunsystem auf einen neuen Infektionserreger und wie nachhaltig ist sein Erinnerungsvermögen? Diese wesentlichen Fragen müssen möglichst detailreich beantwortet werden, um Menschen erfolgreich mit einer aktiven Immunisierung vor Pathogenen schützen zu können. Für die Impfstoffforschung ist dabei von zentraler Bedeutung, welche konkreten Oberflächenstrukturen (Epitope) des Eindringlings als fremd erkannt werden und eine Induktion der erworbenen (adaptiven) Immunantwort herbeiführen. Zu beachten ist dabei, dass häufig eine polyklonale Immunantwort vorliegt, also mehrere Epitope eines körperfremden Moleküls vom menschlichen Immunsystem erkannt werden, so dass verschiedene Immunzellen gemeinsam zur effektiven Bekämpfung beitragen.
Verhängnisvolle Zacken
Bei SARS-CoV-2 imponieren die aus der Virushülle herausragenden Spike-Glykoproteine als „Zacken der Krone“. Die prägnanten Strukturen binden im Sinne eines Türöffners an die transmembranären ACE2-Rezeptoren (Angiotensin-konvertierendes Enzym 2) der Wirtszellen und ermöglichen so die virale Aufnahme und spätere Replikation, stellen aber auch zugleich die „Achillesferse“ des Virus dar. Denn es sind unter anderem Epitope des Spike-Proteins (S), welche eine spezifische Immunantwort auslösen, weshalb es auch primäre Zielstruktur derzeitiger Impfstoffkandidaten ist. Die alleinige Fokussierung auf das Spike-Protein als antigene Struktur wird jedoch nicht der vermutlich vielschichtigen natürlichen Immunantwort gerecht, die auch andere SARS-CoV-2-Proteine als fremd erkennt (Membran (M)- und Nukleokapsidprotein (N)-Epitop sowie weitere Nichtstrukturproteine).
Adaptive Immunantwort
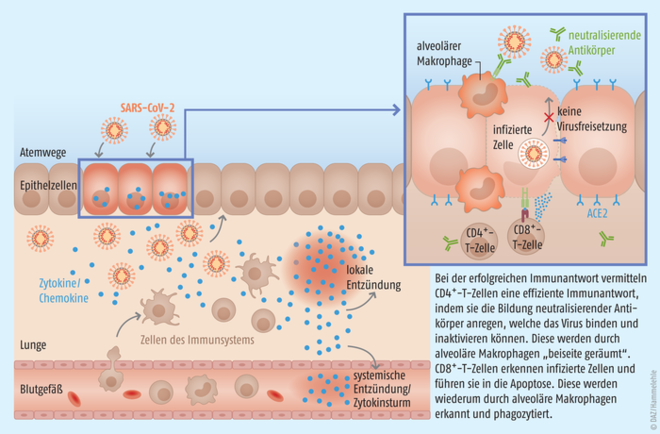
Zum besseren Verständnis des Zusammenspiels der adaptiven und humoralen Immunantwort auf eine SARS-CoV-2-Infektion werden im folgenden Abschnitt und in Abb. 1 die wichtigsten Grundzüge noch einmal dargestellt. Eine Schlüsselstellung nehmen bei diesen Mechanismen verschiedene T-Zell-Subtypen als Vertreter der zellulären Immunität ein.
Abb. 1: SARS-CoV-2 infiziert Zellen, die den Oberflächenrezeptor ACE2 exprimieren. Der Körper erkennt die Infektion und schüttet proinflammatorische Zytokine und Chemokine aus, welche Zellen des Immunsystems an den Ort der Infektion locken. Bei einer gestörten Immunantwort kann sich eine systemische Entzündung und der gefürchtete Zytokinsturm entwickeln, bei adäquater immunologischer Reaktion werden infizierte Zellen rasch eliminiert, bevor sich das Virus ausbreitet (adaptiert nach Abbildungen der Atriva Therapeutics GmbH und Nature Reviews Immunology).
Antigen-präsentierende Zellen (APZ), zum Beispiel Makrophagen, B-Lymphozyten oder dendritische Zellen, nehmen bei einer viralen Infektion das Virus im Rahmen der unspezifischen Abwehr auf, zersetzen es proteolytisch und präsentieren virale Fragmente (Peptide) auf ihrer Oberfläche mithilfe sogenannter MHC-Proteine. An den Infektionsort gelockte T-Zellen suchen körpereigene Zellen, wie die APZ, nach körperfremden Anzeichen ab. Erkennen sie einen Komplex aus MHC-Protein und gebundenem Fragment, welche ein zusammengesetztes Epitop bilden, binden sie mit ihrem T-Zell-Rezeptor daran. Hierdurch wird aus der milliardengroßen Masse an T-Zellen die für das virale Epitop spezifische T-Zelle aktiviert und selektiv unter dem Einfluss von Interleukinen vermehrt sowie entsprechende Gedächtniszellen angelegt. Der an MHC-Klasse-II-Moleküle bindende T-Zell-Subtyp ist die T-Helferzelle, welche eine effiziente Immunantwort durch Kommunikation mit anderen Immunzellen vermittelt. Sie wird auch als CD4-Lymphozyt bezeichnet, da sie virale Fragmente auf der Oberfläche von B-Lymphozyten über ihren T-Zell-Rezeptor mit Unterstützung des Co-Rezeptors CD4 erkennt (CD4+). Unter Zytokinausschüttung aktiviert sie den spezifischen B-Lymphozyten, welcher zu Antikörper-produzierenden Plasmazellen ausreift. Die löslichen Antikörper (Immunglobuline) neutralisieren und inaktivieren das Virus beziehungsweise markieren es für andere eliminierende Immunzellen (zum Beispiel für die in den Lungenbläschen lokalisierten alveolären Makrophagen, s. Abb. 1). Auch von den B-Lymphozyten werden Gedächtniszellen angelegt, die bei erneutem Kontakt mit demselben Krankheitserreger diesen bekämpfen können. Ein zweiter Subtyp, die zytotoxische T-Zelle (Tc-Zelle) übernimmt hingegen die Aufgabe, Virus-befallene Wirtszellen selektiv in den programmierten Zelltod (Apoptose) zu leiten und somit zu eliminieren. Als wichtiger Co-Rezeptor bei der Bindung durch den T-Zell-Rezeptor an MHC-Klasse-I-Moleküle dient der zytotoxischen T-Zelle das CD8-Membranprotein, sie wird daher auch als CD8+ bezeichnet. Gelingt die Aktivierung virusspezifischer zytotoxischer T-Zellen frühzeitig, kann das Krankheitsgeschehen gestoppt werden, bevor sich das Virus verbreitet und relevanten Schaden anrichtet. Bei einer defizitären Immunantwort können die exzessive Infiltration von Monozyten, Makrophagen und T-Zellen, sowie die daraus resultierende starke und nicht zielgerichtete Produktion pro-inflammatorisch wirkender Zytokine zum sogenannten Zytokinsturm führen (s. DAZ 2020, Nr. 25, S. 34).
SARS-CoV-2-reaktive T-Zellen bei Gesunden
Wissenschaftler der Berliner Charité und weiterer Berliner Forschungsinstitute charakterisieren in einer Vorveröffentlichung ausführlich die T-Zell-Antwort bei SARS-CoV-2 [1]. Ihre Daten legen erstmals solide nahe, dass sich eine frühere Exposition mit humanen endemischen Erkältungs-Coronaviren (HCoV) auf die Immunantwort gegenüber SARS-CoV-2 auswirken könnte. Aufbauend auf Forschungsaktivitäten zu früheren SARS- und MERS-Coronavirus-Ausbrüchen war bekannt, dass eine Kreuzreaktivität in der T-Zell-Antwort durch die „harmloseren“ Verwandten möglich ist. In der Berliner Kohorte wurden 18 Blutproben von hospitalisierten COVID-19-Patienten und 68 Blutproben SARS-CoV-2-naiver Kontrollpersonen zur möglichen T-Zell-Reaktivität auf bestimmte Epitope des Spike-Proteins (S) untersucht. Bei 83% der COVID-19-Patienten fanden sich T-Zellen des Typs CD4+ (T-Helferzellen), die auf S reagierten, aber auch bei 34% der Blutproben SARS-CoV-2-naiver Kontrollpersonen. Das Immunsystem der gesunden Kontrollpersonen hätte also auf das virale Spike-Protein (kreuz)reagiert, obwohl es vorher nicht in Kontakt mit SARS-CoV-2 gekommen war. Alle 68 gesunden Kontrollpersonen wurden positiv auf IgG-Antikörper gegen die vier Erkältungs-Coronaviren getestet, interessanterweise zeigten aber nicht alle kreuzreagierende T-Zellen. Eine Korrelation zwischen einer IgG-Antikörperantwort auf HCoV und S-reaktiven T-Zellen besteht also nicht. Zu hinterfragen ist, weshalb nicht alle COVID-19-Patienten eine T-Zell-Antwort zeigten. Die meisten Patienten ohne adäquate T-Zell-Antwort waren durch kritische Krankheitszustände gekennzeichnet, welche aber auch bei anderen Patienten trotz reaktiver T-Zellen auftraten.
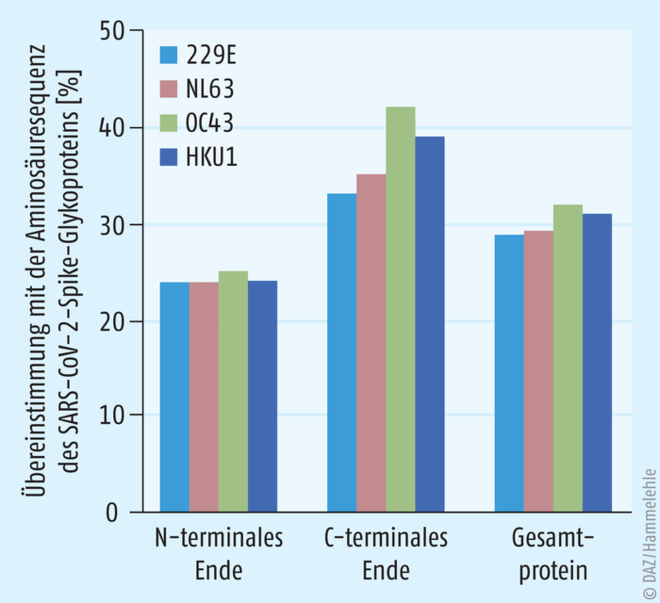
Die Homologie macht’s
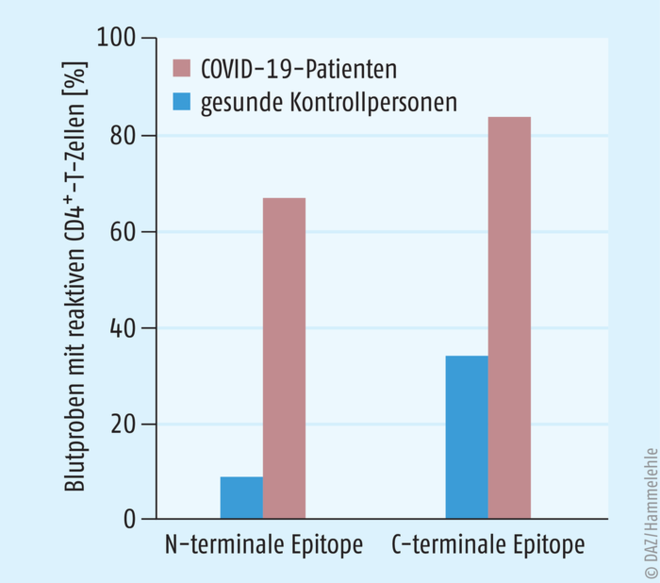
Bei genaueren Untersuchungen fanden die Berliner Wissenschaftler heraus, welche Epitope besonders gut von den T-Gedächtniszellen gesunder, reaktiver Kontrollpersonen detektiert wurden: CD4+-T-Zellen reagierten fast ausschließlich auf C-terminale Sequenzen des SARS-CoV-2-Spike-Proteins und weniger auf dessen N-terminale Sequenzen (s. Abb. 2). Diese Beobachtung ist insofern von Bedeutung, da Erstgenannte eine größere Homologie zu den humanen Erkältungs-Coronaviren aufweisen (s. Abb. 3). Das N-terminale Ende von SARS-CoV-2 grenzt sich hingegen deutlicher von seinen harmloseren „Verwandten“ ab und können daher der Theorie nach weniger gut von T-Gedächtniszellen eines HCoV-„vorgewarnten“ Immunsystems erkannt werden. Interessanterweise enthält das gut erkannte C-terminale Peptidende nicht die Rezeptorbindedomäne (RBD) des Spike-Proteins, welche als Ziel für neutralisierende Antikörper fungiert, sondern kodiert für andere Proteine (CP, FP, TM). Die CD4+-T-Zellantwort in den Blutproben der COVID-19-Patienten fiel erwartungsgemäß spezifischer und umfassender aus: hier richteten sich T-Gedächtniszellen sowohl gegen die C-terminalen, als auch gegen die N-terminalen Epitope des Spike-Proteins von SARS-CoV-2 (83% und 67%), steuerten also Epitope beider Peptidenden gleichmäßiger an (s. Abb. 2).
Ab. 2: Darstellung CD4+-T-Zell-Reaktionen der Berliner Untersuchung auf N- oder C-terminale Epitope des Spike-Glykoproteins bei COVID-19-Patienten und gesunden Kontrollpersonen. Die Reaktion von CD4+-T-Zellen richtet sich bei gesunden Kontrollpersonen vornehmlich gegen C-terminale Epitope des Spike-Glykoproteins. Bei COVID-19-Patienten besteht ebenfalls eine bevorzugte Reaktion der CD4+-T-Zellen auf die C-terminalen Epitope, das Verhältnis N-terminal- zu C-terminal-reaktiver Blutproben ist jedoch ausgeglichener [1].
Abb. 3: Anteil übereinstimmender Aminosäuresequenzen des Spike-Glykoproteins von SARS-CoV-2 mit den vier endemischen humanen Erkältungs-Coronaviren HCoV-229E, HCoV-NL63, HCoV-OC43 und HCoV-HKU1, bezogen auf das N- und das C-terminale Ende sowie auf das Gesamtprotein. Zu erkennen ist, dass C-terminale Molekülabschnitte unter den verschiedenen Coronaviren höher konserviert sind als N-terminale Sequenzen [1].
Vorkommen von CD8+-T-Zellen
Die Vermutung der Berliner Wissenschaftler, dass CD4+-T-Gedächtniszellen nach einer vorherigen Infektion mit Erkältungs-Coronaviren nicht nur bei einer Reinfektion reagieren, sondern theoretisch auch – aufgrund der Ähnlichkeit viraler Epitope – bei einer bisher unbekannten Infektion mit SARS-CoV-2 zu einer schnellen Immunantwort beitragen könnten, wurde wenig später von Forschern aus San Diego ebenfalls geäußert [2]. Hier untersuchte man nicht nur die CD4+-, sondern auch die CD8+-T-Zell-Reaktionen. Analysiert wurden Blutproben von zehn genesenen, mild bis moderat erkrankten COVID-19-Patienten, die aufgrund der Erkrankung nicht hospitalisiert werden mussten und Blutproben, die zwischen 2015 und 2018 von elf gesunden Kontrollpersonen genommen wurden. Bei allen COVID-19-Patienten wurden CD4+-T-Zellen nachgewiesen, bei 70% auch CD8+-T-Zellen. Man konnte zeigen, dass das Ausmaß der Spike-spezifischen CD4+-T-Zell-Reaktivität mit den gemessenen IgG- und IgA-Antikörper-Titern, welche sich gegen die RBD des Spike-Proteins richten, korrelierte. Einige gesunde Kontrollpersonen wiesen wie bei der Berliner Untersuchung kreuzreagierende T-Zellen auf, hier konnten sogar bei der Hälfte der Individuen CD4+-T-Zellen detektiert werden und bei 20% auch CD8+-T-Zellen. Während sich die T-Zell-Antwort der untersuchten COVID-19-Patienten vornehmlich gegen das SARS-CoV-2-Spike-Protein richtete (27%), aber auch gegen das M- (21%), N- (11%) und weitere Proteine, steuerten die kreuzreagierenden T-Zellen gesunder Kontrollpersonen vornehmlich andere Epitope an. Sie richteten sich zwar zu 23% gegen das Spike-Protein, aber nicht oder nur marginal gegen das M- oder das N-Protein und zu bemerkenswerten 54% gegen Nichtstrukturproteine (nsp) von SARS-CoV-2. Bei der Impfstoffentwicklung sollten daher neben dem Spike-Protein zusätzliche antigene Strukturen wie das M- und das N-Protein mit adressiert werden, um möglichst viele potenzielle CD4+-Zielstrukturen anzubieten.
Kein Beweis für Immunität
Die Erkenntnisse beider Studien könnten ein Indiz (aber kein Beweis!) dafür sein, dass Personen mit dieser Art von Hintergrundimmunität eher einen milden oder asymptomatischen Verlauf nehmen, da ihr Immunsystem in Teilen vorbereitet ist und durch zirkulierende Gedächtniszellen schneller reagieren kann, wohingegen andere schwerer erkranken. Da Schätzungen zufolge immerhin jede fünfte Erkältungskrankheit von heimischen Coronaviren ausgelöst wird [1], ist die Wahrscheinlichkeit einer Exposition in der Bevölkerung durchaus hoch. Auch könnte dies zu den Erklärungsversuchen beitragen, weshalb Kinder, die häufigere Erkältungen pro Jahr erleiden, seltener und milder an COVID-19 erkranken. Die vielversprechenden Beobachtungen dürfen jedoch nicht dahingehend fehl- oder überinterpretiert werden, dass ein Drittel bis die Hälfte der Bevölkerung gegen SARS-CoV-2 immun sei. Die Berliner Forscher planen, das immunologische Geschehen und mögliche Faktoren für milde oder schwere Krankheitsverläufe anhand größerer COVID-19-Populationen zu untersuchen [3]. Gezielt sollen auch bisher nicht erkrankte Risikopersonen beprobt werden, bei denen eine spätere Infektion wahrscheinlicher ist, zum Beispiel bei Pflegeheimbewohnern [3]. Im Falle einer Infektion wolle man dann schauen, welchen Erkrankungsverlauf Personen mit kreuzreagierenden T-Zellen nehmen. Dadurch könnte geklärt werden, ob sie besser vor einer Infektion oder vor einem schweren Verlauf geschützt sind als diejenigen ohne potenzielle T-Zell-Hintergrundimmunität.
Auf einen Blick
- Neue Erkenntnisse zur T-Zell-Antwort auf SARS-CoV-2 runden das bisherige immunologische Verständnis ab und liefern Erkenntnisse für die Impfstoffforschung.
- COVID-19-Patienten zeigen robuste CD4+-T-Zell-Antworten auf das C-terminale und das N-terminale Ende des Spike-Glykoproteins.
- In einer Berliner Untersuchung wurden reaktive CD4+-T-Zellen bei 34% SARS-CoV-2-naiver Kontrollpersonen gefunden, in einer amerikanischen Untersuchung sogar bei 50%.
- Anzunehmen ist, dass aufgrund von Homologien in der Aminosäuresequenz des Spike-Proteins zu humanen Erkältungs-Coronaviren insbesondere das C-terminale Ende erkannt wird, aber auch Nichtstrukturproteine.
- Die Untersuchungen legen eine potenzielle Hintergrundimmunität durch humane Erkältungs-Coronaviren nahe, beweisen sie aber nicht.
Hintergrundimmunität testen?
Bisherige Versuche, eine Hintergrundimmunität zu testen, beschäftigten sich ausschließlich mit dem Nachweis zirkulierender Antikörper gegen SARS-CoV-2. In einem Interview mit dem Nachrichtenportal „Zeit Online“ wurde Professor Andreas Thiel, einer der Berliner Studienleiter, zu der interessanten Überlegung befragt, ob ein Test auf kreuzreagierende T-Zellen für breite Bevölkerungsschichten denkbar wäre [3]. „Es wird jetzt so schnell keinen Test in der Apotheke geben“, so Thiel, da das eingesetzte Verfahren derzeit noch zu kompliziert sei. Er sehe aber das Potenzial, dass ein T-Zell-Nachweis bei entsprechender finanzieller Unterstützung Einzug in die allgemeine Diagnostik halten könnte, ähnlich wie ein Test auf Antikörper. |
Literatur:
[1] Braun J et al. Presence of SARS-CoV-2-reactive T cells in COVID-19 patients and healthy donors. medRxiv 2020.04.17.20061440; doi: https://doi.org/10.1101/2020.04.17.20061440
[2] Grifoni A et al. Targets of T cell responses to SARS-CoV-2 coronavirus in humans with COVID-19 disease and unexposed individuals. Cell 2020. doi: https://doi.org/10.1016/j.cell.2020.05.015.
[3] Schumann F. Coronavirus-Kreuzimmunität: „Vergangene Erkältungen könnten vor einem schweren Verlauf schützen“. ZEIT ONLINE 16.06.2020
Weitere Beiträge des Pandemie Spezial in DAZ 2020, Nr. 27
- Germany! 12 million ... Deutschland ist einer der wenigen Staaten mit einer (funktionierenden) Corona-Warn-App
- CHMP macht Weg für Remdesivir frei: Bedingte Zulassung für Therapie von COVID-19 wird in Kürze erwartet
- Virenschleuder Klimaanlage? Risiko der Corona-Verbreitung durch Kühlungs- und Belüftungssysteme
- Keine generelle antibiotische Prophylaxe: Das Superinfektionsrisiko bei COVID-19 scheint in der Frühphase gering zu sein
- Corona-Ticker: Neuigkeiten zu SARS-CoV-2 in Kürze
























0 Kommentare
Das Kommentieren ist aktuell nicht möglich.