
- DAZ.online
- News
- Apotheke
- So sollen ...
Empfehlung der DAB-Kommission
So sollen Cannabisextrakte künftig in der Apotheke geprüft werden
Berlin - 20.05.2019, 16:30 Uhr
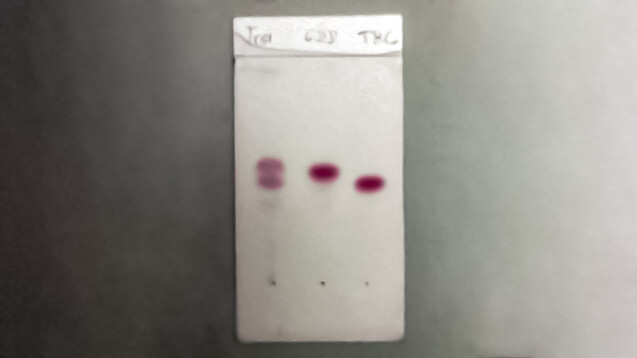
Die Trennung der Cannabinoide CBD und THC bei der Cannabis-DC ist nicht trivial. Die DAB-Kommission hat einen neuen Entwurf zur Prüfung von Cannabisextrakten erarbeitet, bei der noch ein drittes Cannabinoid, nämlich CBN, mit auf die Platte aufgetragen werden soll. ( r / Foto: Berthold Pohl - hier abgebildet noch die bisherige Methode mit zwei Cannabinoiden)
Keine Mikro-DC-Platten verwenden
Die stationäre und mobile Phase ist bei dem neuen Entwurf genauso wie bei der Cannabinoid-DC in der DAB-Blütenmonographie. Und zwar werden die Lösungen auf octadecylsilyliertem Kieselgel F254 R Platten aufgetragen und die polare mobile Phase besteht aus einer Mischung von 15 Volumenteilen Essigsäure 99 % R, 15 Volumenteilen Wasser R und 70 Volumenteilen Methanol R.
Da das CBN-Molekül eine Hydroxylgruppe weniger als CBD enthält, haftet dieses besser auf der stationären apolaren Phase und weist eine kürzere Laufstrecke als CBD auf. Die THC-Zone liegt etwas unterhalb der CBN-Zone. Die Gesamtlaufstrecke beträgt 6 cm. Mikro-DC-Platten sind daher ungeeignet. Da sich die drei Cannabinoide hinsichtlich ihrer physiko-chemischen Eigenschaften nur geringfügig unterscheiden, ist es für eine erfolgreiche Zonentrennung ohnehin nicht empfehlenswert, die vorgegebene Laufstrecke zu unterschreiten.
Nach dem Sprühen rasch auswerten
Zur Detektion soll, wie auch bei den anderen Vorschriften, nach Erhitzen im Trockenschrank das Vanillin-Sprühreagenz verwendet werden. Das Reagenz färbt die Cannabinoide violett. Allerdings hält die Färbung nicht lange an, weshalb es ratsam ist, die DC zeitnah nach dem Sprühen auszuwerten, nachdem die gröbsten Dämpfe verflogen sind. Unterm UV-Licht fluoreszieren die Cannabinoide nur schwach, weshalb sich die UV-Lampe leider nicht als Alternative zum Sprühen eignet.

Cannabis auf Rezept
Medizinalcannabis
Die Neuerungen in der Vorschrift ermöglichen bei der Trennung und Detektion eine verbesserte Qualitätskontrolle der Methode. Allerdings müssen Apotheker statt bisher zwei nun drei Referenzlösungen kaufen. Wer nur wenige Cannabispatienten hat, für den waren schon der Kauf von CBD und TCH-Lösungen à rund 140 Euro bereits eine schmerzhafte Investition. Außerdem ist der Arbeitsaufwand beim Herstellen der Lösungen höher.
Die DAB-Empfehlung mit entsprechenden Prüfvorschriften wurde vom BfArM vor wenigen Tagen im Bundesanzeiger veröffentlicht und kann noch bis zum 1. Juli kommentiert werden. Entsprechende Stellungnahmen sind an die Geschäftsstelle der Arzneibuch-Kommissionen im Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, zu richten.



























2 Kommentare
Lobby Arbeit
von Werner Wolff am 21.05.2019 um 11:07 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Wie immer die Frage:
von Karl Friedrich Müller am 20.05.2019 um 17:50 Uhr
» Auf diesen Kommentar antworten | 0 Antworten
Das Kommentieren ist aktuell nicht möglich.